-
 吳江區原料藥eCTD推薦
吳江區原料藥eCTD推薦FDA圍繞eCTD發布了10余項法規指南,涵蓋格式要求、文件生命周期、數據安全等細節,其中《ICH M2 EWG》作為綜合性技術文件,成為企業申報的參考。eCTD的實施提升了審評效率,通過標準化XML結構和電子簽章技術,減少了紙質遞交的物流與時間成本,同時支持...
2025-10-22 -
 新疆eCTD推薦
新疆eCTD推薦eCTD的法規框架與技術規范:歐盟eCTD的fa規層級包括指南(Guidelines)、指令(Directive)和fa規(Regulation)。其中,fa規(如CTR)具有直接fa律效力,而指南(如ICH eCTD規范)則為技術操作提供參考。eCTD的結構...
2025-10-22 -
 合肥eCTD便宜
合肥eCTD便宜eCTD提交流程與ESG系統:FDA要求通過電子提交網關(ESG)傳輸eCTD文件,單個文件大小限制為10GB,超限需拆分或通過物理介質(如光盤)遞交。提交前需預分配申請號(如NDA編號),并通過ESG測試賬戶驗證技術合規性。序列號命名規則為4位數字(如000...
2025-10-22 -
 工業園區藥品注冊eCTD哪家好
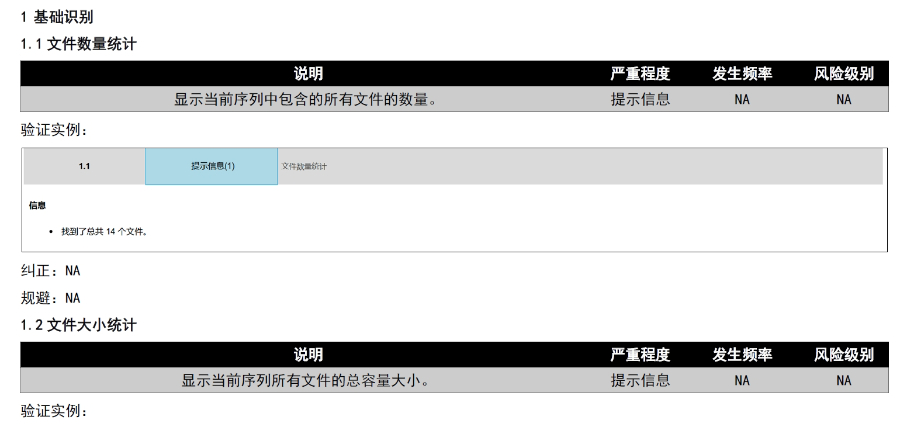
工業園區藥品注冊eCTD哪家好《ZHONG國eCTD驗證實踐手冊》作為2025年2月發布的技術指南(發布日期見),為YAO品注冊申請人提供了系統化的eCTD申報驗證操作指引。該手冊基于《ZHONOG國eCTD驗證標準》的框架,重點覆蓋驗證流程中的六大關鍵領域:基礎識別、文件/文...
2025-09-22 -
 無錫電子申報eCTD性價比高
無錫電子申報eCTD性價比高eCTD的技術架構與模塊要求:美國eCTD基于XML技術,嚴格遵循ICHM4框架,分為5個模塊:模塊1(地區行政信息)、模塊2(技術總結)、模塊3-5(質量、非臨床與臨床數據)。其中,模塊1需包含FDA特定的,涵蓋申請編號、聯系人和DMF授權書等行...
2025-09-22 -
 寧波生物制品eCTD服務放心可靠
寧波生物制品eCTD服務放心可靠技術壁壘與興市場挑戰 非洲和東南亞國家逐步采納eCTD,但其IT基礎設施薄弱導致實施進度滯后。歐盟通過“eCTD全球化倡議”提供技術援助,幫助興市場建立驗證體系和培訓中心。跨國藥企需針對不同區域定制遞交策略,例如在模塊1附加本地穩定性數據。 監管科學與創激勵 ...
2025-09-22 -
 上海藥品注冊eCTD遞交
上海藥品注冊eCTD遞交文件生命周期管理:eCTD支持文件替換(Replace)、刪除(Delete)等操作,而非增文件。例如,更臨床研究方案時需用Replace操作覆蓋舊版本。基線提交(BaselineSubmission)可用于補充歷史紙質資料,但需在封面函中聲明無內容變更。臨床...
2025-09-22 -
 黑龍江化學藥品eCTD
黑龍江化學藥品eCTDeCTD提交流程與ESG系統:FDA要求通過電子提交網關(ESG)傳輸eCTD文件,單個文件大小限制為10GB,超限需拆分或通過物理介質(如光盤)遞交。提交前需預分配申請號(如NDA編號),并通過ESG測試賬戶驗證技術合規性。序列號命名規則為4位數字(如000...
2025-07-16 -
 南京生物制品eCTD注冊系統
南京生物制品eCTD注冊系統技術壁壘與興市場挑戰 非洲和東南亞國家逐步采納eCTD,但其IT基礎設施薄弱導致實施進度滯后。歐盟通過“eCTD全球化倡議”提供技術援助,幫助興市場建立驗證體系和培訓中心。跨國藥企需針對不同區域定制遞交策略,例如在模塊1附加本地穩定性數據。 監管科學與創激勵 ...
2025-05-14 -
 吳江區賦悅科技eCTD供應商
吳江區賦悅科技eCTD供應商美國eCTD的強制實施時間與范圍:美國自2017年5月5日起要求藥申請(NDA)、仿制藥申請(ANDA)和生物制品許可申請(BLA)必須通過eCTD格式提交,2018年5月5日進一步擴展至臨床試驗申請(IND)和藥品主文件(DMF)。FDA通過《聯邦食品、藥品...
2025-05-14 -
 上海化學藥品eCTD格式
上海化學藥品eCTD格式2015年發布《關于藥品醫療器械審評審批制度的意見》,提出藥監五大目標,將eCTD納入國家藥監數字化戰略。2017年,中國加入ICH(國際人用藥品注冊技術協調會),成為全球第八個監管機構成員,加速與國際標準接軌。2018年,國家藥監局(NMPA)完成eCTD文...
2025-05-09 -
 南京新藥eCTD找哪家
南京新藥eCTD找哪家經濟影響與成本效益 盡管初期投入較高(平均每企業需50萬歐元),但eCTD可減少30%的審評延遲成本,長期效益。仿制藥企業通過eCTD復用原研數據,節省80%的申報準備時間。歐盟預算撥款2億歐元資助中小企業完成數字化轉型。 倫理審查與數據隱私 eCTD中的患者...
2025-04-26 -
 蘇州賦悅科技eCTD
蘇州賦悅科技eCTD美國eCTD的強制實施時間與范圍:美國自2017年5月5日起要求藥申請(NDA)、仿制藥申請(ANDA)和生物制品許可申請(BLA)必須通過eCTD格式提交,2018年5月5日進一步擴展至臨床試驗申請(IND)和藥品主文件(DMF)。FDA通過《聯邦食品、藥品...
2025-04-25 -
 南京國內注冊eCTD注冊系統
南京國內注冊eCTD注冊系統多國審評程序與eCTD遞交途徑的適配:歐盟藥品審評程序包括集中(CP)、分散(DCP)、互認(MRP)和國家程序(NP),eCTD需適配不同程序的遞交要求。例如: ?集中審評程序(CP)?:通過EMA的eSubmission Gateway提交,審評時限約24...
2025-04-25 -
 高新區生物制品eCTD服務電話
高新區生物制品eCTD服務電話《中國eCTD驗證實踐手冊》作為2025年2月發布的技術指南(發布日期見),為藥品注冊申請人提供了系統化的eCTD申報驗證操作指引。該手冊基于《中國eCTD驗證標準V1.0》的框架,重點覆蓋驗證流程中的六大關鍵領域:基礎識別、文件/文件夾規范、ICH骨架文件完...
2025-04-25 -
 生物制品eCTD注冊系統
生物制品eCTD注冊系統歐美eCTD實施經驗豐富,中國可借鑒以加速進程。中國可能會經歷從企業自愿eCTD提交到強制eCTD提交的過渡,且將緊隨ICH步伐,尤其在CMC資料整理方面。全球正向eCTD 4.0過渡,中國也不例外,將隨日本、歐盟、美國等強制實施而逐步推進。 中國崛起帶來全球...
2025-04-25 -
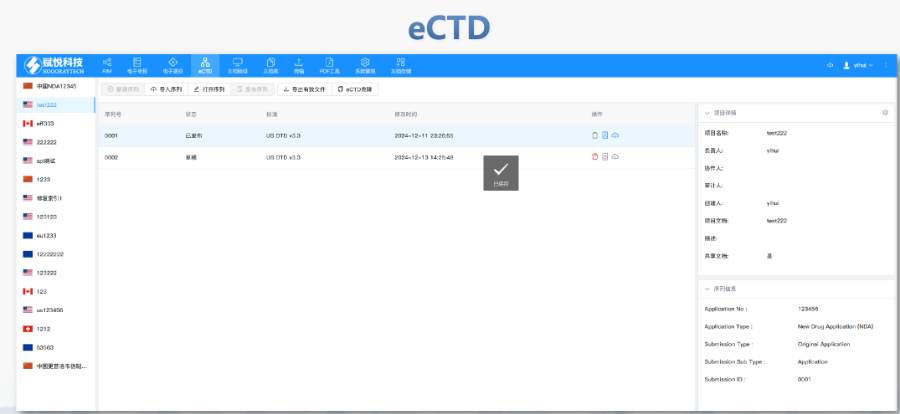 閔行區INDeCTD是什么
閔行區INDeCTD是什么文件生命周期管理:eCTD支持文件替換(Replace)、刪除(Delete)等操作,而非增文件。例如,更臨床研究方案時需用Replace操作覆蓋舊版本。基線提交(Baseline Submission)可用于補充歷史紙質資料,但需在封面函中聲明無內容變更。 ...
2025-04-25 -
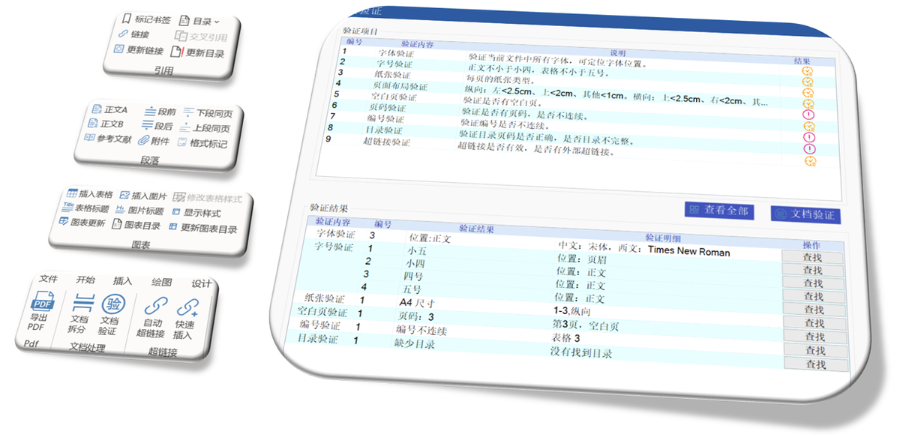 化學藥品eCTD銷售電話
化學藥品eCTD銷售電話歐盟eCTD的歷史沿革與強制實施 歐盟自2003年逐步推進eCTD(電子通用技術文檔)的標準化進程,初要求藥注冊申請(MAA)采用CTD格式。2010年,集中審評程序(CP)率先強制使用eCTD,隨后分散程序(DCP)和互認程序(MRP)分別于2015年、20...
2025-04-25 -
 閔行區CDE eCTD文件如何制作
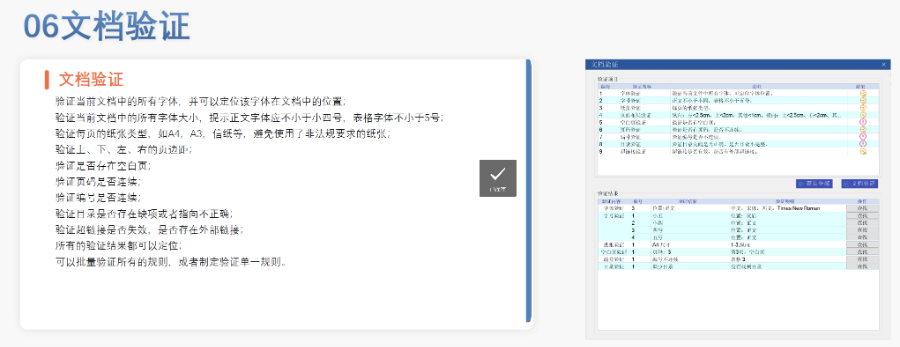
閔行區CDE eCTD文件如何制作eCTD驗證標準的嚴格性與分類:歐盟對eCTD的驗證要求分為“錯誤”“警告”和“提示信息”三級,其中“錯誤”項直接導致申報被拒。驗證項目涵蓋六大類共149條,包括文件命名規范(如路徑長度限制)、PDF可讀性(禁止密碼保護)、XML骨架文件完整性等。例如,文件擴...
2025-04-25 -
 杭州化學藥品eCTD報價
杭州化學藥品eCTD報價DMF維護與合規 ?年度更 即使無變更,每年需提交聲明;重大工藝/設施變更需及時通知客戶并更文件。 ?現場檢查 原料藥企業需通過FDA現場檢查,驗證是否符合ICH Q7 GMP標準,并與DMF內容一致。 ?轉讓與關閉 ?轉讓:需書面通知FDA并提供持有者信息。...
2025-04-25 -
 寧波生物制品eCTD名稱
寧波生物制品eCTD名稱電子簽章與安全性 FDA要求所有PDF文件需經數字簽名,并通過MD5校驗確保傳輸完整性。簽章需符合21 CFR Part 11的電子記錄規范,部分情況下允許臨時放寬(如期間的遠程簽署)。 ?多模塊協同驗證 模塊1(行政文件)的區域性元數據(如申請類型、聯系人信...
2025-04-25 -
 上海原料藥eCTD供應商
上海原料藥eCTD供應商歐盟eCTD的歷史沿革與強制實施 歐盟自2003年逐步推進eCTD(電子通用技術文檔)的標準化進程,初要求藥注冊申請(MAA)采用CTD格式。2010年,集中審評程序(CP)率先強制使用eCTD,隨后分散程序(DCP)和互認程序(MRP)分別于2015年、20...
2025-04-25 -
 太倉新藥eCTD發布系統
太倉新藥eCTD發布系統文件生命周期管理:eCTD支持文件替換(Replace)、刪除(Delete)等操作,而非增文件。例如,更臨床研究方案時需用Replace操作覆蓋舊版本。基線提交(Baseline Submission)可用于補充歷史紙質資料,但需在封面函中聲明無內容變更。 ...
2025-04-25 -
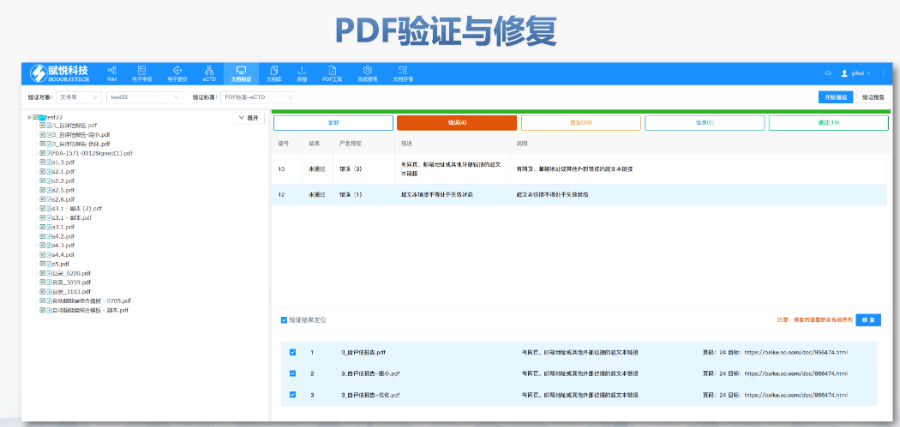 閔行區賦悅科技eCTD軟件
閔行區賦悅科技eCTD軟件美國藥物主文件(Drug Master File, DMF)是向FDA提交的機密技術文件,用于支持藥品生產、質量控制及合規性審查。以下為申報的要點和流程總結: DMF概述與類型 ?定義與作用 DMF是藥品生產全過程的詳細檔案,包含原料藥、輔料、包裝材料等的生產...
2025-04-25 -
 寧波電子申報eCTD格式
寧波電子申報eCTD格式eCTD生命周期管理與變更提交:歐盟要求eCTD申報資料覆蓋藥品全生命周期,包括提交、補充申請及實質性變更。例如,增成員國需提交“附加成員國序列”,審評時間約52-83天;重大變更(如生產工藝調整)需創建序列并通過CTIS平臺更模塊3和模塊1的GMP證明。技術...
2025-04-25 -
 南京INDeCTD推薦
南京INDeCTD推薦eCTD的實施為監管機構和企業帶來了多重機遇。電子化申報資料能夠極大地加速審評效率,減少人為判斷錯誤和數據混淆的情況,從而提高審評的準確性和速度。同時,eCTD帶來的數據標準化機遇使得全球監管機構的資料內容和電子格式得以統一,有助于在不同監管機構之間進行數據傳...
2025-04-25 -
 蕪湖國際注冊eCTD服務放心可靠
蕪湖國際注冊eCTD服務放心可靠從紙質到電子的歷史過渡 2017年前,美國允許紙質與eCTD并行提交,但此后逐步淘汰紙質通道,保留緊急情況下的例外審批。2020年電子化后,所有IND、NDA、ANDA和DMF強制采用eCTD格式。 ?系統平臺升級 FDA通過“藥品業務應用系統”和“藥品eCT...
2025-04-25 -
 杭州CDE eCTD品牌
杭州CDE eCTD品牌澳大利亞的藥品電子通用技術文檔(eCTD)注冊申報體系是澳大利亞y藥品商品管理局(TGA)推動藥品審評現代化的重要舉措。eCTD作為國際通行的電子化注冊申報標準,通過結構化數據格式(如XML)整合了藥品質量、安全性和有效性的技術文檔,實現了從傳統紙質遞交向數字...
2025-04-25 -
 蕪湖CDE eCTD服務電話
蕪湖CDE eCTD服務電話澳大利亞的藥品電子通用技術文檔(eCTD)注冊申報體系是澳大利亞y藥品商品管理局(TGA)推動藥品審評現代化的重要舉措。eCTD作為國際通行的電子化注冊申報標準,通過結構化數據格式(如XML)整合了藥品質量、安全性和有效性的技術文檔,實現了從傳統紙質遞交向數字...
2025-04-25 -
 海南藥品注冊eCTD
海南藥品注冊eCTD美國藥物主文件(Drug Master File, DMF)是向FDA提交的機密技術文件,用于支持藥品生產、質量控制及合規性審查。以下為申報的要點和流程總結: DMF概述與類型 ?定義與作用 DMF是藥品生產全過程的詳細檔案,包含原料藥、輔料、包裝材料等的生產...
2025-04-25