高新區藥品注冊eCTD性價比
eCTD在歐盟藥品監管中的歷史背景:歐盟eCTD(電子通用技術文檔)的發展始于對臨床試驗和藥品審評流程標準化的需求。2001年,歐盟引入《臨床試驗指令》(CTD)作為統一的法律框架,但其分散的成員國申報機制導致效率低下。2014年,歐盟通過《臨床試驗法規》(CTR, Regulation EU No. 536/2014),要求通過CTIS平臺(臨床試驗信息系統)集中提交臨床試驗申請(CTA),并逐步推動eCTD作為電子化申報的工具。這一旨在解決傳統CTD模式下審評周期長、多國協調成本高的問題,為eCTD的實施奠定了基礎。加拿大eCTD注冊外包相關技術支持。高新區藥品注冊eCTD性價比
美國eCTD驗證采用三級分類:“錯誤”(必須修正)、“警告”(建議修正)、“提示信息”(參考)。例如,PDF文件版本不符或加密保護屬于“錯誤”,而書簽路徑非相對性則可能列為“警告”。驗證失敗將直接導致退審,企業需通過LORENZ Validator等工具預檢,確保提交前合規。 技術驗證點 驗證涵蓋XML結構合規性、文件命名規則、生命周期管理(如序列號連續性)及PDF屬性(如字體嵌入、可搜索性)。臨床試驗數據需額外滿足CDISC標準,包括SDTM和ADaM數據集的結構驗證合肥ANDAeCTD注冊系統瑞士NDA注冊申報相關技術支持。
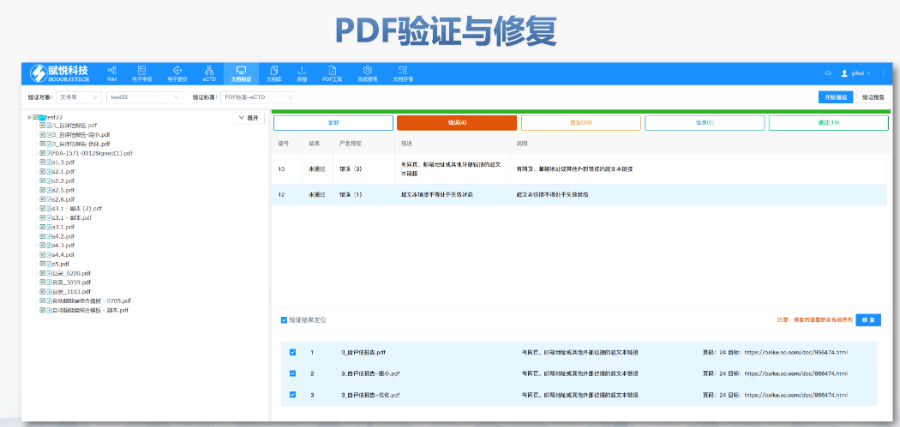
電子遞交的合規性與FENG險管理歐盟要求申請人確保電子資料與紙質版本完全一致,若未在規定時間提交紙質文件可能導致注冊終止。驗證過程中,“錯誤”級別問題(如文件命名不規范、XML邏輯錯誤)必須修正,而“警告”和“提示信息”則建議優化以提升審評體驗。EDQM和EMA均提供驗證工具,申請人需在遞交前完成內部預驗證。G方費用結構與支付流程歐盟eCTD遞交費用因審評程序類型而異:集中程序費用較高,涵蓋科學評估和合規審查成本;G家程序費用由各成員國自行設定。CEP申請需向EDQM支付評審費,具體金額根據原料YAO類型和變更復雜度分級。繳費需通過G方指定渠道完成,并附上付款憑證作為模塊1的組成部分。多語言支持與翻譯要求盡管歐盟允許使用英語提交,但部分成員國要求模塊一的行政文件翻譯為本地語言。臨床試驗數據庫(如SDTM和ADaM)需以英語呈現,同時提供雙語標簽以支持多國審閱。Z業翻譯服務在確保技術術語準確性方面至關重要,尤其針對復雜YAO學和非臨床數據。
2020年暴發后,FDA進一步推動電子化進程,例如允許遠程電子簽章和臨時放寬部分格式要求,但驗證標準(如PDF版本、書簽鏈接有效性)并未降低。這一時期的實踐為eCTD在緊急審批中的靈活性提供了案例,也凸顯了其作為危機應對工具的價值。 盡管美國尚未部署eCTD V4.0,但其技術方向已明確:支持醫療器械和保健品申報、增強數據可復用性、優化審評系統與人工智能的集成。此外,區塊鏈技術在電子簽章和數據溯源中的應用探索,可能成為下一階段升級的重點。加拿大NDA注冊申報相關技術支持。

生命周期管理與變更遞交eCTD支持全生命周期管理,申請人需通過序列更(Sequence)反映yao品變更信息。例如CEP的更需提交“變更說明表”,對比已批準和擬修改內容,并附修訂版技術文檔。重大變更(如生產工藝調整)可能觸發GMP現場檢查,EDQM將根據feng險評估決定是否啟動核查。電子簽名與法律效力歐盟接受符合《電子簽名法》的數字簽名,手寫簽名的掃描件需嵌入PDF并加密保護。模塊1的申請表和承諾書必須包含you效簽名,且XML文件需通過MD5校驗確保完整性。若使用第三方簽署工具,需提前向監管機構報備并獲取技術認可。中小企業支持與資源獲取EMA和EDQM為中小企業提供eCTD實施指南、驗證工具及培訓研討會。例如,EDQM官網發布CEP遞交模板和案例庫,EMA則定期更Q&A文檔以解答常見問題。此外,歐盟設立專項基金,資助中小企業完成eCTD轉換和系統部署。 瑞士eCTD注冊外包相關技術支持。蘇州仿制藥eCTD文件如何制作
加拿大eCTD申報相關技術支持。高新區藥品注冊eCTD性價比
GDUFAIII框架與費用分類2022年更的GDUFAIII將費用分為ANDA申請費、DMF認證費、項目費及設施費四類,實施周期至2027年。2025財年ANDA費用長至約22萬美元,較2024年增幅達,反映審評成本上升。ANDA申請費規則費用需在提交時繳納,若申請被拒可退還75%。重提交視為申請,需再次繳費。關聯API的工廠數量影響總費用,例如某ANDA引用3個API且涉及6家工廠,需支付6倍DMF費用。DMF費用機制II類原料yaoDMF需在引用前繳費,一次性支付約(2025財年)。未繳費DMF不得用于支持ANDA,否則觸發退審。項目費分級管理根據企業獲批ANDA數量分為大、中、小型三級,2025年大型企業年費約34萬美元。附屬公司ANDA數量合并計算,繳費責任可由母公司或任一附屬公司承擔。 高新區藥品注冊eCTD性價比
- 上海國產eCTD名稱 2025-10-22
- 吳江區原料藥eCTD推薦 2025-10-22
- 合肥國內注冊eCTD發布軟件 2025-10-22
- 新疆eCTD推薦 2025-10-22
- 合肥ANDAeCTD使用 2025-10-22
- 靜安區國際注冊eCTD名稱 2025-10-22
- 合肥eCTD便宜 2025-10-22
- 歐盟eCTD發布軟件 2025-10-22
- 靜安區CDE eCTD常用解決方案 2025-10-22
- 江蘇賦悅科技eCTD推薦 2025-10-22
- 初中物理仿真實驗軟件下載安裝 2025-11-05
- 溫州2513彩膜面板UV打印機廠家 2025-11-05
- 鎮江綜合AndroidAPP開發 2025-11-05
- 重慶研析在線分析設備解決方案 2025-11-05
- 上海什么潛影防偽標識 2025-11-05
- 嘉興網絡機房安裝 2025-11-05
- 南昌建筑實名制人社平臺 2025-11-05
- 安徽智能云服務 2025-11-05
- 雅安協同云鏈項目管理系統 2025-11-05
- 淮安怎樣辦公自動化系統指導 2025-11-05