-
廣東眾塑 pla 快遞緩沖材料亮相:破除物流包裝污染難題
-
廣東眾塑 pla 文具系列上市:為學(xué)生群體打造 “環(huán)保學(xué)習(xí)裝
-
廣東眾塑 pla 一次性餐盒推出:餐飲外賣 “綠色包裝” 新
-
廣東眾塑pla 花盆系列面市:提供 “可降解” 種植新選
-
廣東眾塑 pla 兒童餐具套裝上市:食品級材質(zhì) + 高性價比
-
廣東眾塑 pla 膜袋全新登場:替代傳統(tǒng)塑料袋
-
廣東眾塑 pla 一次性刀叉勺上市:餐飲環(huán)保新選擇
-
廣東眾塑 pla 馬桶蓋重磅面市:解決傳統(tǒng)塑料蓋污染痛點
-
廣東眾塑 pla 3D 打印材料全新上市:高性價比賦能創(chuàng)意
-
廣東眾塑持續(xù)發(fā)力,推動 pla 聚乳酸在彩妝包裝領(lǐng)域廣泛應(yīng)用
靜安區(qū)國際注冊eCTD名稱
美國藥物主文件(Drug Master File, DMF)是向FDA提交的機密技術(shù)文件,用于支持藥品生產(chǎn)、質(zhì)量控制及合規(guī)性審查。以下為申報的要點和流程總結(jié): DMF概述與類型 定義與作用 DMF是藥品生產(chǎn)全過程的詳細檔案,包含原料藥、輔料、包裝材料等的生產(chǎn)設(shè)施、工藝、質(zhì)量控制等信息,供制劑廠商引用以支持其注冊申請。其意義在于保護企業(yè)機密的同時,滿足FDA對供應(yīng)鏈透明度的要求。 DMF類型 Ⅱ類:原料藥、中間體及制劑(如微生物外泌體、細胞株等生物制品均屬此類)。 Ⅲ類:包裝材料。 Ⅳ類:輔料、著色劑等添加劑。 Ⅴ類:非臨床/臨床數(shù)據(jù)等特殊信息(需FDA預(yù)先批準(zhǔn))。 注:Ⅰ型(生產(chǎn)設(shè)施與人員)已于2000年停用。加拿大DMF注冊申報關(guān)技術(shù)支持。靜安區(qū)國際注冊eCTD名稱
DMF維護與合規(guī)年度更即使無變更,每年需提交聲明;重大工藝/設(shè)施變更需及時通知客戶并更文件。現(xiàn)場檢查原料YAO企業(yè)需通過FDA現(xiàn)場檢查,驗證是否符合ICHQ7GMP標(biāo)準(zhǔn),并與DMF內(nèi)容一致。轉(zhuǎn)讓與關(guān)閉轉(zhuǎn)讓:需書面通知FDA并提供持有者信息。關(guān)閉:未提交年度報告或持有人主動申請,需說明原因并通知所有授權(quán)方。關(guān)鍵注意事項數(shù)據(jù)質(zhì)量:所有資料需準(zhǔn)確、完整,減少審核延遲FENG險。合規(guī)性:遵循FDA指南(如21CFRPart207)及USP標(biāo)準(zhǔn)(如培養(yǎng)基物料來源級別)。溝通機制:建議通過專YE機構(gòu)(如FUYUE)協(xié)助,定期提交周報并制定計劃表以提高效率。常見問題解答生WU制品分類:培養(yǎng)基、外泌體等均屬Ⅱ類DMF。質(zhì)量標(biāo)準(zhǔn):參考USP及同行標(biāo)準(zhǔn),需提供分析方法驗證及雜質(zhì)對比研究。周期估算:資料準(zhǔn)備約5-50個工作日,總周期受缺陷回復(fù)影響。 INDeCTD是什么澳大利亞DMF注冊申報相關(guān)技術(shù)支持。
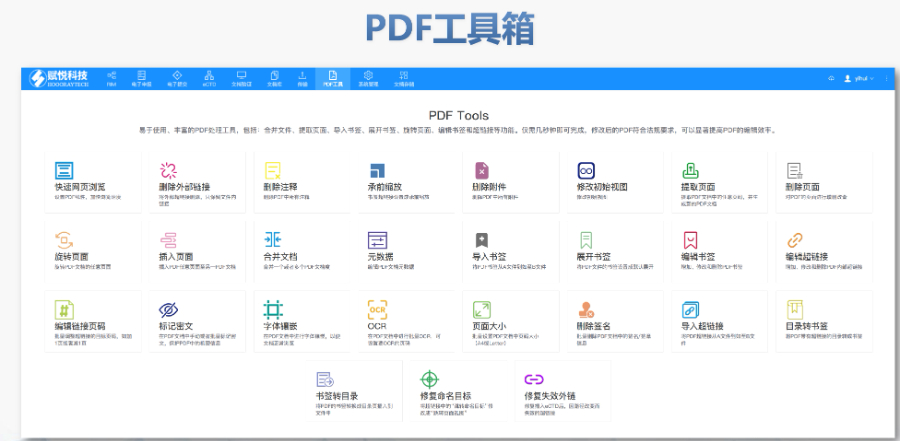
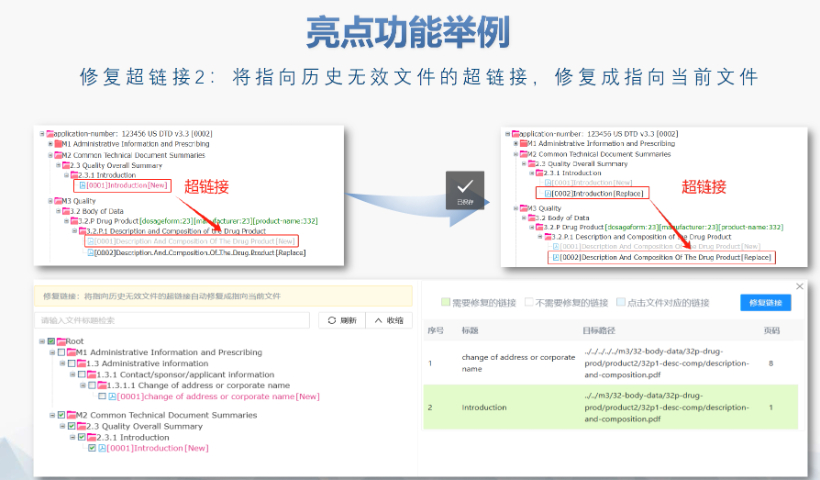
eCTD文件制作需遵循嚴格的法規(guī)要求和標(biāo)準(zhǔn)化流程,以下是關(guān)鍵要點整理:eCTD采用模塊化結(jié)構(gòu),包含模塊1(行政信息)至模塊5(臨床報告),需按ICH和監(jiān)機構(gòu)要求構(gòu)建目錄樹。顆粒度選擇:文件提交層級需在***申報時確定并沿用,例如原料和制劑的章節(jié)(如、)需按比較低顆粒度拆分,輔料單獨成章。PDF需添加書簽(導(dǎo)航目錄)和超鏈接(跨網(wǎng)頁跳轉(zhuǎn)),超過5頁的文件必須包含目錄(TOC/LOT/LOF)。技術(shù)參數(shù):初始視圖需設(shè)置默認縮放級別和頁面布局,書簽展開層級不超過三級,單文件大小需符合申報系統(tǒng)限制。驗證工具:使用軟件(如BXeCTD)自動生成書簽和超鏈接,并通過序列校驗和PDF校驗功能確保合規(guī)性。
危機應(yīng)對與應(yīng)急遞交機制在公共衛(wèi)生緊急事件(如COVID-19)中,EMA允許簡化eCTD序列,優(yōu)先審評關(guān)鍵模塊并暫緩非數(shù)據(jù)。申請人可通過快su通道(FastTrack)提交yi苗或yao物的eCTD資料,審評周期可壓縮至6個月。此類申請需附feng險評估報告,并承諾后續(xù)補交完整數(shù)據(jù)。數(shù)據(jù)安全與長期存檔歐盟要求eCTD資料存檔期限至少為yao品上市后30年,EMA采用分布式存儲和區(qū)塊鏈技術(shù)確保數(shù)據(jù)不可篡改。申請人需定期備份本地副本,并使用符合GDPR要求的加密傳輸協(xié)議(如AS2)遞交。歷史數(shù)據(jù)的遷移和格式轉(zhuǎn)換(如NeeS轉(zhuǎn)eCTD)需遵循特定技術(shù)規(guī)范。huan保效益與可持續(xù)發(fā)展eCTD取代紙質(zhì)遞交后,歐盟每年減少約500噸紙張消耗,審評流程的數(shù)字化降低碳足跡約30%。虛擬審評會議和電子簽名進一步減少了差旅需求,契合歐盟2050碳中和目標(biāo)。未來,。 美國IND注冊申報相關(guān)技術(shù)支持。
設(shè)施費動態(tài)調(diào)整 API工廠和制劑工廠年費分別約6.8萬和14.5萬美元(2025財年),CMO工廠費用為制劑費的24%。國外工廠需額外支付1.5萬美元跨境檢查費。 繳費時限與懲罰 費用需在財年首日(10月1日)起20天內(nèi)繳納,逾期將列入拖欠名單并暫停ANDA受理,涉事藥品視為冒牌產(chǎn)品。 豁免與特殊情形 PET藥物、非商業(yè)產(chǎn)品及停產(chǎn)超一年的工廠可豁免繳費。已繳費工廠若年度內(nèi)無生產(chǎn)活動,仍需繳納費用。 行業(yè)影響與策略 費用上漲推動企業(yè)優(yōu)化申報策略,例如集中ANDA提交周期、采用CMO外包降低設(shè)施費,并通過預(yù)認證(如DMF完整性評估)減少重復(fù)支出。美國NDA注冊申報相關(guān)技術(shù)支持。徐匯區(qū)ANDAeCTD便宜
中DMF注冊申報相關(guān)技術(shù)支持。靜安區(qū)國際注冊eCTD名稱
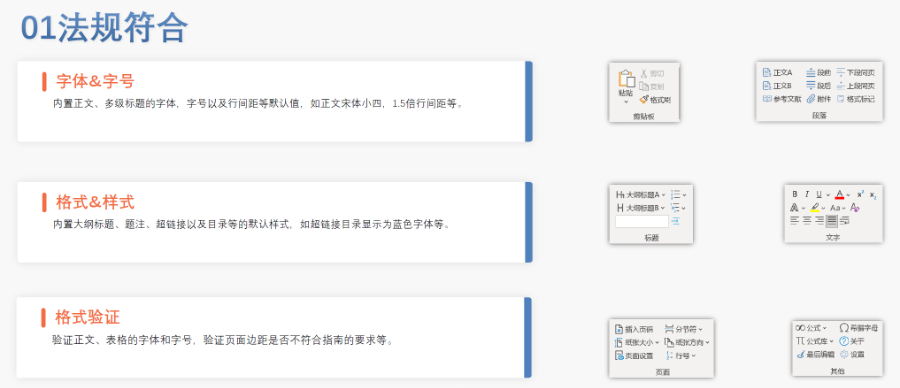
電子簽章與安全性 FDA要求所有PDF文件需經(jīng)數(shù)字簽名,并通過MD5校驗確保傳輸完整性。簽章需符合21 CFR Part 11的電子記錄規(guī)范,部分情況下允許臨時放寬(如期間的遠程簽署)。 ?多模塊協(xié)同驗證 模塊1(行政文件)的區(qū)域性元數(shù)據(jù)(如申請類型、聯(lián)系人信息)需與模塊2-5的內(nèi)容邏輯一致。例如,生物制品的3.2.R擴展節(jié)點命名需遵循特定規(guī)則,而化學(xué)藥品則禁止使用此類擴展。 ?驗證工具與流程 主流工具如LORENZ eValidator支持自動化驗證,生成包含錯誤定位與修復(fù)建議的詳細報告。企業(yè)需在提交前完成內(nèi)部驗證,并通過“藥品業(yè)務(wù)應(yīng)用系統(tǒng)”推送受理狀態(tài)。 ?常見問題與規(guī)避策略 高頻錯誤包括PDF安全設(shè)置、書簽鏈接失效、STF(研究標(biāo)簽文件)缺失等。例如,未在5.3.1章節(jié)標(biāo)注研究ID會導(dǎo)致驗證警告,需通過說明函解釋。企業(yè)可通過建立標(biāo)準(zhǔn)化模板庫和預(yù)檢流程降低風(fēng)險。 ?后續(xù)監(jiān)管與更 FDA定期更驗證標(biāo)準(zhǔn)(如2022年增臨床試驗數(shù)據(jù)完整性檢查),企業(yè)需通過訂閱官方通知或第三方服務(wù)商獲取動態(tài)靜安區(qū)國際注冊eCTD名稱
- 上海國產(chǎn)eCTD名稱 2025-10-22
- 吳江區(qū)原料藥eCTD推薦 2025-10-22
- 合肥國內(nèi)注冊eCTD發(fā)布軟件 2025-10-22
- 新疆eCTD推薦 2025-10-22
- 合肥ANDAeCTD使用 2025-10-22
- 靜安區(qū)國際注冊eCTD名稱 2025-10-22
- 合肥eCTD便宜 2025-10-22
- 歐盟eCTD發(fā)布軟件 2025-10-22
- 靜安區(qū)CDE eCTD常用解決方案 2025-10-22
- 江蘇賦悅科技eCTD推薦 2025-10-22
- 初中物理仿真實驗軟件下載安裝 2025-11-05
- 溫州2513彩膜面板UV打印機廠家 2025-11-05
- 鎮(zhèn)江綜合AndroidAPP開發(fā) 2025-11-05
- 重慶研析在線分析設(shè)備解決方案 2025-11-05
- 上海什么潛影防偽標(biāo)識 2025-11-05
- 嘉興網(wǎng)絡(luò)機房安裝 2025-11-05
- 南昌建筑實名制人社平臺 2025-11-05
- 安徽智能云服務(wù) 2025-11-05
- 雅安協(xié)同云鏈項目管理系統(tǒng) 2025-11-05
- 淮安怎樣辦公自動化系統(tǒng)指導(dǎo) 2025-11-05