浙江合規性內毒素檢測法規要求
來源:
發布時間:2025-10-08
《中國藥典》對內毒素檢測提出了非常嚴格的要求,以確保藥品的質量和安全性。湖州申科生物提供一系列高質量的細菌內毒素檢測產品,旨在為實驗室和工廠生產提供準確、快速的檢測方案,產品涵蓋了凝膠法鱟試劑、動態顯色法鱟試劑、重組C因子法(rFC)和重組級聯試劑(rCR)、無熱原吸頭、內毒素檢查用水、自動化設備、內毒素工作標準品、內毒素指示劑等多種產品,滿足不同場景下的需求,同時可為復雜樣品基質的內毒素檢測提供解決方案。
內毒素檢測方法多樣,影響因素及實驗干擾較多,包括實驗操作步驟、樣品處理等方面。浙江合規性內毒素檢測法規要求
重組級聯試劑作為內毒素檢測鱟試劑的理想替代方案,其具備的優勢有:①優化的G因子級聯反應,無G因子旁路干擾。采用基因重組技術表達鱟血細胞中的C因子(Factor C)、B因子(Factor B)和凝固酶原(Proclotting enzyme),無G因子旁路干擾,排除1,3-β-D葡聚糖假陽性風險。②依然采用動態顯色法原理,可沿用天然鱟試劑檢測設備。重組級聯試劑(rCR),與天然鱟(動態顯色法)具有相同的操作流程、檢測設備、分析方法,用戶可以沿用天然鱟的儀器、軟件、耗材、人員培訓、驗收程序等,無需投入額外成本。③具有與天然鱟的相同反應機制,檢測結果具有等效性。完全模擬了天然鱟試劑的酶聯反應,由3種蛋白組成的級聯反應機制提供了信號放大的過程,確保了檢測的準確性和靈敏度。湖州申科按照藥典要求進行替代方法驗證,無縫銜接技術轉移,助力用戶從方法驗證到工藝落地,從數據合規到全球申報。
原料藥內毒素檢測動態顯色法鱟試劑湖州申科生物為內毒素檢測提供替代方法驗證,包含重組級聯試劑(rCR)與天然鱟試劑的橋接數據。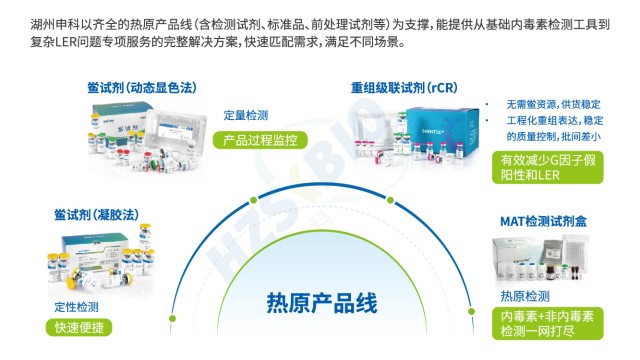
內毒素檢測的實驗方案需遵循“標曲可靠性驗證(靈敏度復核)-稀釋倍數計算-干擾試驗”的完整流程,以保障檢測結果準確合規。首先進行標曲可靠性試驗,用標準內毒素制備至少3個濃度的稀釋液(相鄰濃度間稀釋倍數不超過10,下限濃度不低于鱟試劑標示檢測限),每濃度設 3 支平行管,同時做2支陰性對照;當陰性對照的吸光度小于或透光率大于標準曲線下限的檢測值或反應時間大于標準曲線下限的反應時間,對數據進行線性回歸,相關系數r的幅值≥0.980時試驗方有效,否則需重新操作。接著按公式 L=K/M 確定樣本內毒素限值,K 值依給藥途徑而定,M結合人均60kg體重、1.62m2 體表面積及上限給藥劑量計算,也可參考藥典行標。隨后明確有效稀釋上限倍數(MVD),即供試品允許稀釋的上限倍數,確保在此范圍內檢測限值。再開展樣本干擾試驗,制備供試品溶液(A)、供試品加標溶液(B,加標濃度為標曲中點)、標準曲線溶液(C)及陰性對照(D),按公式 R=(Cs-Ct)/λm×100%計算加標回收率,50%-200%為合格;若鱟試劑、生產工藝等發生變化,需重新進行干擾試驗,保障內毒素檢測的可靠性。
湖州申科建立了標準化的低內毒素回收(LER)技術服務流程,全周期支撐內毒素檢測優化:7 個自然日內完成客戶溝通與 LER 確認,用天然鱟、重組鱟等方法檢測并出具報告;60 個自然日開展方法開發,分析 LER 成因(如螯合劑、蛋白質 IP)并研究去掩蔽方案;30 個自然日進行 HTS 驗證,完成 3 批 LER 實驗與干擾實驗,交付穩定試劑盒、操作規程及培訓;再協助方法轉移與 cGMP 驗證。流程每環節均圍繞內毒素檢測展開,確保企業高效解決 LER 問題,滿足法規要求。
進行重組級聯試劑時,不同酶標儀檢測樣本 Onset time 有差異,因信號采集方式和靈敏度不同。
內毒素檢測方法易受樣品基質干擾,法規要求在方法應用前必須進行干擾驗證,選擇標準曲線中點或一個靠近中點的內毒素濃度,作為供試品干擾試驗種添加的內毒素濃度計算回收率,若回收率在 50%-200% 范圍內,表明無明顯干擾;若回收率異常,需通過過濾、中和、透析、加熱處理等方式優化樣品前處理。方法學確認還需涵蓋線性范圍(如 0.005-5 EU/mL)、精密度(批內 CV≤15%)、檢測限(LOD≤0.01 EU/mL)等指標,確保方法在實際樣品檢測中穩定可靠,符合《美國藥典》 <85>、《中國藥典》通則 1143 等藥典要求。
鱟試劑含多種酶和輔助因子,批次間活性差異可能導致內毒素檢測結果變異性。合規性內毒素檢測技術服務表面活性劑會改變內毒素活性,用重組級聯試劑檢測前需稀釋樣本,消除其對反應的干擾。浙江合規性內毒素檢測法規要求
當實驗室更換內毒素檢測方法或更換試劑供應商時,需進行方法比對與橋接驗證。比對實驗需選取至少 3批代表性樣品,分別用新舊方法檢測,計算結果相關性(如相關系數 R2≥0.95)和偏差(≤20%)。橋接驗證還需評估新方法的特異性、靈敏度是否與舊方法一致,如確認對高風險樣品(如含 β- 葡聚糖的樣品)的抗干擾能力相當。若方法變更涉及法規申報產品,需將驗證數據納入申報資料,證明變更后方法仍能有效控制內毒素風險,符合 FDA、NMPA 等監管機構對方法變更的合規性要求。
浙江合規性內毒素檢測法規要求
下一篇:
上海高效內毒素檢測
相關新聞
- 湖北Vero宿主細胞殘留DNA檢測生產企業 2025-11-06
- 江蘇ELISA法宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-11-06
- 上海熱原檢測體系 2025-11-06
- 廣東CHO宿主細胞蛋白(HCP)殘留檢測 2025-11-06
- 北京化學制藥熱原檢測MAT試劑盒 2025-11-06
- 黑龍江熱原檢測 2025-11-06
- 江蘇生物制品宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-11-06
- 上海合規性熱原檢測操作步驟 2025-11-06
- 浙江熱原檢測操作步驟 2025-11-06
- 江蘇CHO宿主細胞蛋白(HCP)殘留檢測試劑盒 2025-11-06
推薦新聞
- 西寧多重細胞因子檢測方法 2025-11-06
- 河南醫療產品體系建設 2025-11-06
- 北京點射光纖半導體激光治療儀1470nm波長光纖傳導直達病灶 2025-11-06
- 一次性醫療監測設備EO滅菌費用 2025-11-06
- 北京綜合高鹽核酸酶價格表 2025-11-06
- 海南UN38.3電池包 2025-11-06
- 兒童脊柱評估系統定制 2025-11-06
- 廣東指骨夾板大概多少錢 2025-11-06
- 天津本地醫用刻錄機技術指導 2025-11-06
- 浙江強腦智能假肢哪家便宜 2025-11-06