上海熱原檢測單核細胞活化反應測定法
來源:
發布時間:2025-10-30
MAT 試劑盒熱原檢測配套細胞的質量控制,是保障檢測結果可靠的重要環節,需從功能、安全性、穩定性三方面建立體系。在功能鑒定上,按歐洲 MAT 法要求,需檢測細胞的 Toll 樣受體(TLR1-TLR9)表達情況—確保細胞能響應不同類型熱原(如 TLR4 響應 LPS、TLR2/6 響應脂磷壁酸);同時考察細胞倍增時間(確保活性穩定)、熱原反應性(對標準內毒素和非內毒素熱原的信號強度),確保細胞具備熱原識別與炎癥因子分泌能力。在安全性檢測上,需驗證細胞無菌(無細菌、真菌污染)、無支原體、無外源病毒因子(如 HIV、HBV)及分枝桿菌,避免外源污染影響檢測結果。在穩定性考察上,需監測不同代次細胞的熱原刺激敏感性,一般要求細胞使用代次不超過 20 代,代次過高會導致 TLR 表達下降、炎癥因子分泌減少,影響檢測靈敏度。湖州申科的配套細胞還額外通過 Western blot 驗證 TLR 受體表達量,并用不同非內毒素熱原配體刺激驗證響應性,形成全維度質量控制,確保細胞適配熱原檢測需求。
熱原具有頑強穩定性、耐熱性(180℃/2h才能破壞)、水溶性、濾過性,可穿透常規滅菌屏障。上海熱原檢測單核細胞活化反應測定法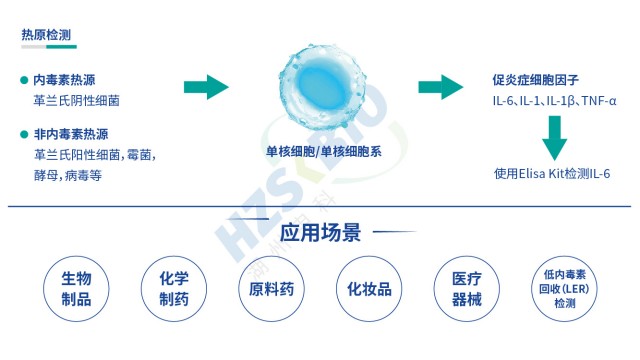
傳統細菌內毒素檢查法(BET)只能檢測革蘭氏陰性菌的 LPS,無法識別革蘭氏陽性菌 LTA、真菌酵母多糖、病毒鞭毛蛋白等非內毒素熱原,存在漏檢風險;同時,部分樣品(如脂質體、表面活性劑制劑)會因內毒素吸附導致低內毒素回收(LER),BET法難以準確定量。MAT 法通過單核細胞表面的多種 TLR 受體(TLR1-TLR10),可識別不同類型熱原:TLR4 識別 LPS、TLR2/TLR6 識別 LTA 與酵母多糖、TLR5 識別鞭毛蛋白、TLR3 識別病毒 dsRNA 等,實現 “全熱原覆蓋”。湖州申科生物熱原檢測試劑盒(MAT法)的驗證數據顯示,其對不同濃度非內毒素熱原均有響應:如 0.1-100μg/mL 鞭毛蛋白可檢測到 0.005-0.035EU/mL熱原活性,0.1-10μg/mL LTA 對應 0.1-0.7EU/mL 熱原活性,1-100μg/mL 雷西莫特(TLR7/8 配體)對應 0.5-3.0EU/mL 熱原活性。此外,MAT法檢測的是熱原的生物活性(而非單純 LPS 含量),可避免 LER 導致的假陰性,為CGT等高風險產品提供更有保障的熱原檢測方案。
疫苗熱原檢測技術服務進行熱原實驗時,樣品有效稀釋倍數上限應通過干擾實驗確定,既保護細胞活性又保證熱原檢測靈敏度。
熱原檢測MAT法的法規地位持續提升,已成為多國藥典認可的熱原檢測替代方法。歐洲藥典(EP)是推動 MAT 應用的關鍵力量:通則 2.6.30 明確 MAT 可替代家兔熱原試驗(RPT),且能同時檢測內毒素與非內毒素熱原;2024 年歐洲藥典委員會批準刪除所有條款中的家兔法,修訂文本將于 2025 年7月1日生效,強制鼓勵使用 MAT 等體外替代方法。美國藥典(USP)<151> 規定,經驗證的體外熱原試驗(如 MAT)可替代家兔法,且需依據 USP<1225>開展驗證;FDA 行業指南進一步明確 MAT 的合規性。中國藥典 2020 年版通則 9301 將 MAT 列為熱原檢查的補充方法,雖暫未替代家兔法,但明確其適用于復雜基質樣品的全熱原篩查。此外,ISO 10993-1、ICCVAM 等國際標準也優先推薦體外熱原檢測模型,全球法規協同推動 MAT 成為熱原檢測的主流技術。
MAT 法熱原檢測的穩定性需從細胞、試劑、操作、樣品四維度嚴格把控。細胞層面,細胞活性與純度直接決定熱原響應能力,活性不足會減少炎癥因子分泌,純度低則引入雜細胞干擾;細胞批次間一致性也關鍵,TLR 受體表達、倍增時間差異會導致結果波動。試劑與耗材方面,標準品效價需溯源國際標準,避免降解影響標曲;試劑盒中細胞因子需質控,防止外源熱原污染;培養液、緩沖液及無熱原耗材(吸頭、西林瓶)若熱原控制不當,易引發假陽性。操作上,加樣手法要統一(如 8 通道移液器液面一致),孵育需 37℃、5% CO?穩定環境,試劑配制濃度準確,設備(酶標儀、洗板機)定期校準,操作偏差會直接導致異常。樣品層面,自身干擾物質(消除炎癥成分、高鹽)、pH 偏離 6-8 或微生物污染,會抑制細胞活化或引入外源熱原,需針對性預處理。
湖州申科MAT試劑盒適用于生物制品、化學制藥、原料藥、化妝品、醫療器械的熱原檢測。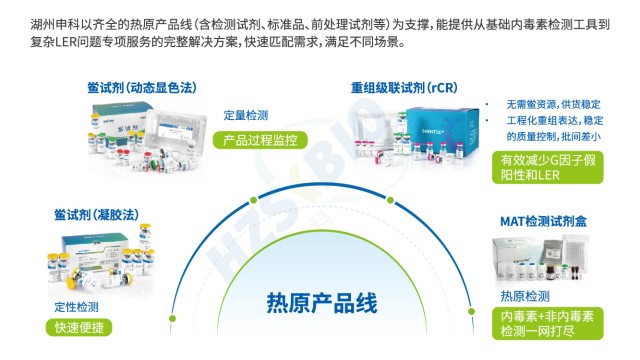
熱原是指微量即可引發恒溫動物體溫異常升高的物質,分為內源性(如細胞因子)與外源性兩類,外源性熱原又涵蓋微生物來源(革蘭氏陰性菌脂多糖 LPS、革蘭氏陽性菌脂磷壁酸 LTA、病毒、真菌等)與非微生物來源(灰塵、橡膠降解產物等)。傳統細菌內毒素檢查法(BET)只能檢測革蘭氏陰性菌的 LPS,無法覆蓋非內毒素熱原,而單核細胞活化試驗(MAT)可彌補這一缺陷。其原理是:熱原通過活化單核細胞表面的 Toll 樣受體(TLR,如 TLR4 識別 LPS、TLR2/TLR6 識別 LTA),啟動先天免疫反應,促使細胞釋放 IL-6、TNF-α 等促炎細胞因子;隨后采用 ELISA 法檢測 IL-6 濃度,結合 LPS 標準曲線推算樣品中總熱原含量,實現對內毒素與非內毒素熱原的同步檢測,契合《中國藥典》9301 指導原則中 全場景防控熱原風險”的要求。
熱原檢測采用人外周血單核細胞(PBMC),優勢是天然受體譜系完整,但供體差異導致變異系數(CV)高達25%。湖北生物制品熱原檢測PBMC(外周血單個核細胞)用于 MAT 檢測時供體差異大,IL-6 釋放波動明顯,標準化難度高于單核細胞系。上海熱原檢測單核細胞活化反應測定法
含消除炎癥成分的樣品可能抑制 IL-6 產生,需通過科學評估排除干擾,確保 MAT 法熱原檢測結果準確。根據藥典要求,若樣品能抑制單核細胞促炎癥因子釋放,需通過以下步驟驗證適用性:首先,選擇樣品 A、2A、4A 倍稀釋(均不超過上限有效稀釋倍數 MVD),避免高濃度消除炎癥成分過度抑制;其次,進行供試品加標回收率實驗,若回收率在 50%-200% 的合格范圍,說明消除炎癥成分未影響熱原檢測;再對比 “供試品配制的標曲” 與 “稀釋液配制的標曲”,若兩者 IL-6 檢測值相差在 ±20% 以內,表明樣品基質對檢測無系統性干擾。例如,某消除炎癥單抗樣品經 2 倍稀釋后,加標回收率達 120%,兩種標曲 IL-6 值相差 15%,判定可適用 MAT 法。若出現回收率偏低(<50%),可嘗試增加稀釋倍數(如 8A 倍)或采用熱滅活(若樣品耐熱)去除消除炎癥活性;若仍無法排除干擾,需結合家兔法進行對比驗證,避免因消除炎癥成分導致假陰性。
上海熱原檢測單核細胞活化反應測定法
上一篇
江蘇合規性熱原檢測商業化試劑盒
相關新聞
- 湖南熱原檢測流程 2025-11-07
- 北京漢遜酵母宿主細胞蛋白(HCP)殘留檢測 2025-11-07
- 北京化學制藥熱原檢測歐盟出口方案 2025-11-07
- 湖北Vero宿主細胞殘留DNA檢測生產企業 2025-11-06
- 江蘇ELISA法宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-11-06
- 上海熱原檢測體系 2025-11-06
- 廣東CHO宿主細胞蛋白(HCP)殘留檢測 2025-11-06
- 北京化學制藥熱原檢測MAT試劑盒 2025-11-06
- 黑龍江熱原檢測 2025-11-06
- 江蘇生物制品宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-11-06
推薦新聞
- 河南血脂代謝神經酸真實貨源 2025-11-07
- 鹽田區質量體外診斷試劑銷售價格 2025-11-07
- 貴州功能性敷料采購 2025-11-07
- 成都SPF級動物實驗室建設 2025-11-07
- 義烏補體成分3(C3)檢測試劑盒(酶聯免疫吸附試驗法) 2025-11-07
- 北京腸道菌群全長檢測 2025-11-07
- 甘肅牛ELISA試劑盒咨詢報價 2025-11-07
- 重慶里昂矯形器廠家電話 2025-11-07
- 松江區推薦紅外線腔體影像檢查儀售價 2025-11-07
- 廣西滅菌咽拭子出口企業 2025-11-07