浙江抗體藥物內毒素檢測操作步驟
來源:
發布時間:2025-10-14
內毒素檢測結果誤差可能源于多環節:試劑方面,鱟試劑(LAL )或試劑批間差異、過期試劑活性下降會導致結果偏差,需通過試劑驗收(如陽性對照回收率驗證)確保質量;操作方面,實驗器具未除熱原(如玻璃器皿未干熱滅菌)、加樣體積不準確會引入污染或誤差,需嚴格執行 SOP(如器皿 250℃干熱滅菌≥30 分鐘);環境方面,實驗室空氣中的微生物孢子、粉塵可能污染樣品,需在潔凈工作臺操作并設置陰性對照。此外,反應溫度波動(偏離 37℃±1℃)會影響酶活性,需使用恒溫孵育器精確控溫,確保反應條件穩定。
在醫藥、生物制品及醫療器械等諸多領域,細菌內毒素檢測是保障產品質量與安全的關鍵環節。浙江抗體藥物內毒素檢測操作步驟
內毒素檢測法規體系正逐步向非動物源試劑傾斜,為重組試劑的應用鋪平道路。美國藥典(USP)已將重組 C 因子(rFC)和重組級聯試劑(rCR)正式收錄,于2025 年 5 月納入 USP-NF,明確要求用戶驗證重組試劑對特定產品的適用性。歐洲藥典(EP)通則 2.6.32 已收錄重組 C 因子法,規定注射用水和純化水可直接采用該方法檢測,復雜基質樣品需通過驗證后使用。日本藥原則通過指導原則<G4-4-180>將重組蛋白試劑列為內毒素檢測的補充方法。中國藥典雖暫未正式收錄重組方法,但 9251《細菌內毒素法應用指導原則》為其應用提供了框架。這些法規進展共同構建了重組試劑的合規應用基礎。
廣東合規性內毒素檢測法規要求內毒素工作標準品(CSE)稀釋液配制時渦旋很重要,可使內毒素充分溶解,保證濃度準確。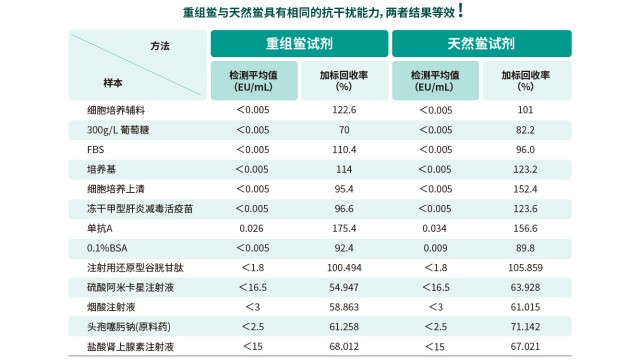
SHENTEK®凝膠法鱟試劑憑借多維度優勢,為細菌內毒素檢測提供高效解決方案: 法規契合度上,嚴格遵循中國藥典(ChP)、美國藥典(USP)、歐洲藥典(EP)及日本藥典(JP)的統一標準,確保檢測結果滿足全球藥品監管要求,為藥品研發、生產及出口提供合規支撐; 抗干擾性能上,配套申科特異性抗增液,可針對性抑制特殊樣品(如中藥注射劑、生物制品)的非特異性反應,突破復雜基質對檢測準確性的干擾,保障數據可靠; 性能適配性上,提供 0.03、0.06、0.125、0.25、0.5 EU/mL 多檔靈敏度選項,覆蓋從高靈敏到常規檢測的多樣化需求;操作易用性上,兼容恒溫儀、水浴鍋、恒溫箱等基礎設備,無需復雜儀器與軟件,降低實驗室硬件門檻,適配不同規模企業; 穩定性保障上,試劑采用凍干粉劑型,2~8℃ 儲存條件下有效期長達 2 年,減少倉儲與使用中的活性損耗,提升批次間一致性; 適用領域上,覆蓋生物制品、血液制品、化學藥品等全品類樣本,從工藝監控到成品放行,全流程支撐藥品安全質控。該試劑通過法規、性能、操作、穩定與適用的協同優化,構建起高效、靈活的內毒素檢測體系,助力行業提升質量管控水平。
內毒素檢測方法驗證需覆蓋多項參數,確保方法可靠:線性范圍需包含樣品預期濃度(如 0.01-10 EU/mL),相關系數 R2≥0.98;準確度通過加標回收率評估,應在 50%-200% 范圍內;精密度包括批內和批間精密度,CV 值均應≤15%;檢測限(LOD)需低于產品限值的 1/2(如限值 0.5 EU/mL,LOD 應≤0.25 EU/mL);專屬性需證明無干擾物質影響(如 β- 葡聚糖、蛋白質不引發假陽性)。驗證通過后,方法需經實驗室負責人批準方可使用,且定期需進行一次回顧性驗證,確認方法持續有效。
重組級聯試劑(rCR)適用于細胞培養輔料、單抗、凍干疫苗等樣本,內毒素檢測適用范圍廣。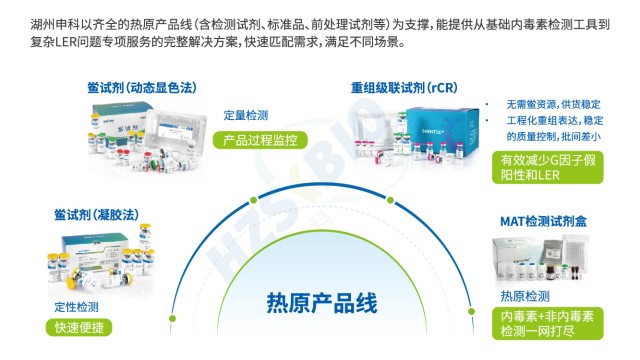
內毒素檢測鱟試劑的反應受pH的干擾。在進行檢測時,要調節被測溶液的pH值,使鱟試劑與供試品溶液的混合溶液pH值落在鱟試劑指定的使用pH范圍內(一般鱟試劑作用pH值在6.0~8.0范圍內)。用于調節pH值的試液或溶液(酸或堿),可采用BET用水配制,并將溶液在無熱原容器中儲存;必須對試液或溶液進行驗證,以證明不含可檢出的內毒素并且無干擾因素。調節pH試劑(酸或堿)的添加量,不應該超過供試品的1092。如果超過10%,則在進行計算時,將DH試劑的添加量的系數計算進去。
細菌內毒素是革蘭氏陰性菌細胞壁脂多糖,細菌死亡裂解釋放,微量級即致人體發熱、休克等威脅。北京抗體藥物內毒素檢測常見問題分析重組級聯試劑(rCR)無動物源,不含 G 因子,可避免 β- 葡聚糖致內毒素檢測假陽性。浙江抗體藥物內毒素檢測操作步驟
內毒素檢測的實驗方案需遵循“標曲可靠性驗證(靈敏度復核)-稀釋倍數計算-干擾試驗”的完整流程,以保障檢測結果準確合規。首先進行標曲可靠性試驗,用標準內毒素制備至少3個濃度的稀釋液(相鄰濃度間稀釋倍數不超過10,下限濃度不低于鱟試劑標示檢測限),每濃度設 3 支平行管,同時做2支陰性對照;當陰性對照的吸光度小于或透光率大于標準曲線下限的檢測值或反應時間大于標準曲線下限的反應時間,對數據進行線性回歸,相關系數r的幅值≥0.980時試驗方有效,否則需重新操作。接著按公式 L=K/M 確定樣本內毒素限值,K 值依給藥途徑而定,M結合人均60kg體重、1.62m2 體表面積及上限給藥劑量計算,也可參考藥典行標。隨后明確有效稀釋上限倍數(MVD),即供試品允許稀釋的上限倍數,確保在此范圍內檢測限值。再開展樣本干擾試驗,制備供試品溶液(A)、供試品加標溶液(B,加標濃度為標曲中點)、標準曲線溶液(C)及陰性對照(D),按公式 R=(Cs-Ct)/λm×100%計算加標回收率,50%-200%為合格;若鱟試劑、生產工藝等發生變化,需重新進行干擾試驗,保障內毒素檢測的可靠性。
浙江抗體藥物內毒素檢測操作步驟
下一篇:
天津生物制品宿主細胞殘留DNA檢測方案
相關新聞
- 福建重組蛋白熱原檢測 2025-11-05
- 江蘇細菌內毒素檢測鱟試劑 2025-11-05
- 浙江合規性熱原檢測 2025-11-05
- 北京生物制品內毒素檢測凝膠法鱟試劑 2025-11-05
- 河南熱原檢測 2025-11-05
- 江蘇合規性熱原檢測規范 2025-11-05
- 河南Human宿主細胞殘留DNA檢測生產企業 2025-11-05
- 上海CHO宿主細胞蛋白(HCP)殘留檢測 2025-11-05
- 單抗藥物用宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-11-05
- 疫苗熱原檢測家兔法替代方案 2025-11-04
推薦新聞
- 云南本地醫用刻錄機廠家電話 2025-11-05
- 楊浦區通用試劑 2025-11-05
- 崇明區智能科技健身服務服務熱線 2025-11-05
- 北京獸用輸尿管結石體外沖擊波碎石機購買指南 2025-11-05
- 湖北全封閉智能醫廢管理收集車生產廠家 2025-11-05
- 上海患者信賴的自動糞菌分離儀運行時間 2025-11-05
- 湖北智護安全一體化管理平臺直銷商 2025-11-05
- 崇明區哪些健身器材批發 2025-11-05
- 事件相關誘發電位投標 2025-11-05
- 枯草芽孢菌株生產廠家 2025-11-05